產品搜索
產品分類
聯係我們
電話:4008750250
手機:18066071954
地址:南京市棲霞區緯地路9號
Email: zhangxiangwen@cobioer.com
新聞動態 / news
胰腺癌重磅級研究盤點(第2期)
原載自:www.mr-eacltd.com[行情動態] 2017-06-28 瀏覽次數:1883
如今,胰腺癌現已經成為(wei) 第七大致死性癌症,患者五年的存活率不到5%。盡管臨(lin) 床醫學的發展使很多癌症已經成為(wei) 了一種可控甚至治愈的疾病,但非常遺憾的是,胰腺癌恰恰是科學家尚未攻克的癌症之一,該病從(cong) 預防、診斷、治療到預後效果並不不理想,隨著人群生活水平的提高及飲食結構的改變,近年來胰腺癌的發病率呈現上升且年輕化的趨勢。
基於(yu) 此,小編胰腺癌研究進展進行一番梳理,以饗讀者。
1.Nature:重大突破!利用靶向KRAS突變基因的外泌體(ti) 治療胰腺癌
doi:10.1038/nature22341
KRAS蛋白晶體(ti) 結構,圖片來自Thomas Splettstoesser/Wikipedia。
外泌體(ti) (exosome)是所有細胞釋放出的病毒大小的顆粒。它們(men) 天然地存在於(yu) 血液中。根據來自美國德州大學MD安德森癌症中心的一項新的研究,對外泌體(ti) 進行基因操縱可能提供一種新的胰腺癌治療方法。相關(guan) 研究結果於(yu) 2017年6月7日在線發表在Nature期刊上,論文標題為(wei) “Exosomes facilitate therapeutic targeting of oncogenic KRAS in pancreatic cancer”。論文通信作者為(wei) 德州大學MD安德森癌症中心癌症生物學係研究員Raghu Kalluri博士。
在這項新的研究中,經過基因修飾的外泌體(ti) (被稱作iExosome)能夠運送特異性地靶向KRAS突變基因的小RNA分子,從(cong) 而導致胰腺癌模式小鼠病情緩解,增加它們(men) 的總存活率。這些研究人員采用了一種被稱作RNA幹擾(RNAi)的靶向方法:利用這些天然的納米顆粒(即外泌體(ti) )運送小幹擾RNA(siRNA)或短發夾RNA(shRNA)分子來靶向胰腺癌細胞中的KRAS突變基因,從(cong) 而影響多種胰腺癌模型的腫瘤負荷和存活。他們(men) 證實外泌體(ti) 能夠作為(wei) 一種的RNAi載體(ti) 發揮作用,這是因為(wei) 這些納米大小的囊泡(即外泌體(ti) )輕鬆地在體(ti) 內(nei) 遷移和進入靶細胞(包括癌細胞)中。
作為(wei) 一種分子通斷開關(guan) 的KRAS發生突變時會(hui) 處於(yu) “開啟”狀態。在80%~95%的胰腺導管腺癌(PDAC)當中,這個(ge) 基因發生突變,這也是這種癌症中zui為(wei) 常見的突變。這些研究人員證實iExosome能夠運送特異性地靶向KRAS的siRNA和shRNA分子,並且比他們(men) 的合成對應物脂質體(ti) (liposome)更加。脂質體(ti) 不具有外泌體(ti) 表現出的天然複雜性和優(you) 勢。
德州大學MD安德森癌症中心癌症生物學助理教授Valerie LeBleu博士說,“我們(men) 的研究提示著與(yu) 脂質體(ti) 相比,外泌體(ti) 表現出運送siRNA分子和抑製侵襲性胰腺瘤生長的優(you) 異能力。我們(men) 也證實外泌體(ti) 表麵上的CD47存在允許它們(men) 躲避來自循環單核細胞的吞噬作用。”
這些研究人員也證實一種被稱作巨胞飲(macropinocytosis)的細胞過程促進發生KRAS基因突變的癌細胞攝取外泌體(ti) 。巨胞飲參與(yu) 細胞清除營養(yang) 物和囊泡。
Kamerkar說,“與(yu) 之前的發現相一致的,由於(yu) 增加的巨胞飲過程,達到胰腺的外泌體(ti) 數量增加可能為(wei) 外泌體(ti) 進入KRAS相關(guan) 的癌細胞提供進一步的優(you) 勢。盡管胰腺瘤存在致密的基質,我們(men) 的結果也支持癌細胞地攝取iExosome。還需開展進一步的研究以便更好地理解通過巨胞飲進入細胞中的外泌體(ti) 是否具有其他的可能增強它們(men) 的抗腫瘤能力的特征。”
2.Sci Trans Med:胰腺癌血液檢測初見成效
doi:10.1126/scitranslmed.aal3226
科學家們(men) zui近發現了一類新的鑒定胰腺癌的血液檢測技術,這一技術能夠幫助早期診斷的進一步提前。
胰腺癌是一類致命的腫瘤類型,而究其原因,是由於(yu) 檢測與(yu) 治療往往不夠及時。這項仍在試驗階段的技術是通過對胰腺腫瘤分泌的*蛋白質進行檢測而診斷腫瘤的發生,這一技術相比目前仍在使用的"CA19-9"技術間更加準確。
該研究的共同作者之一Cesar Castro博士稱CA 19-9療法十分不。具體(ti) 來說,CA 19-9隻有在胰腺癌晚期才會(hui) 有所上升,而此時的診斷結果對於(yu) 治療沒有實際的幫助。此外,被檢測蛋白也並非特異性存在於(yu) 癌細胞中,當胰腺處於(yu) 炎症反應階段,或者膽囊阻塞的時候也會(hui) 有所表達。根據Castro的說法,CA19-9技術在胰腺癌患者的治療過程中追蹤疾病的惡化情況或許有用處,但作為(wei) 診斷標誌物來說則十分不合格。
來自紀念凱瑟琳斯隆癌症中心的胰腺癌專(zhuan) 家Peter Kingham.博士認為(wei) 該新型的血液診斷技術相比CA19-9有了長足的進步。但是,這一研究結果還需要在更多患者群體(ti) 中進行驗證。
該檢測手段是通過芯片技術對癌細胞分泌到血液中的胞外小體(ti) (EV)進行檢測。正常細胞與(yu) 癌細胞都能夠分泌EV,但Castro研究組發現其中包含的5類蛋白質是很好的胰腺癌的生物標記。在其中一項研究中,研究者們(men) 發現該檢測技術的檢測準確率能夠達到86%,特異性也能夠達到81%.
3.OncoImmunology:胰腺癌細胞附近的免疫細胞或可“助紂為(wei) 虐”促進癌症擴散
doi:10.1080/2162402X.2016.1191731
圖片摘自:A*STAR Singapore Immunology Network
日前,一項刊登在雜誌OncoImmunology上的研究報告中,來自A*STAR研究所的研究人員就通過研究提出了證據表明,胰腺腫瘤能夠改變巨噬細胞的代謝,而巨噬細胞被認為(wei) 是真空吸塵器,其能夠捕捉並且消化微生物和細胞殘渣;研究者還發現,發生代謝改變的巨噬細胞還會(hui) 參與(yu) 癌症的擴散,而且通過修飾巨噬細胞代謝的療法或許能夠幫助胰腺癌幹細胞擴散。
腫瘤細胞能夠表現出不同於(yu) 健康細胞的代謝特性,尤其是其會(hui) 有限通過糖酵解的過程來通過葡萄糖產(chan) 生能量,尤其是在富含氧氣的情況下;但本文中研究者Siew Cheng Wong推測,腫瘤或許還會(hui) 改變附近巨噬細胞的代謝特性。為(wei) 了檢測這種推測,研究人員利用衍生自正常胰腺細胞或癌變細胞的培養(yang) 物來產(chan) 生人類的巨噬細胞,結果研究者發現,利用衍生自癌細胞的培養(yang) 物所生長的巨噬細胞能夠表現出不同的代謝特性,此外,這些巨噬細胞還能夠促進血管生長以及癌細胞像遠端器官的轉移和建立,這往往是癌症擴散的標誌。
研究者Wong指出,這項研究中我們(men) 發現了在癌症中巨噬細胞葡萄糖代謝通路會(hui) 受到一定影響;本文研究或許為(wei) 我們(men) 闡明胰腺癌擴散的分子機製提供了一定線索,同時還能夠幫助醫生通過重新調節巨噬細胞的代謝至原始狀態來有效遏製癌症發展。巨噬細胞一種具有高度可塑性的細胞,研究者發現,通過開啟代謝特性來對巨噬細胞進行重編程就能夠逆轉巨噬細胞的特性促進癌症的擴散。
4.Nat Genet:啟動子突變也會(hui) 影響胰腺癌發生
doi:10.1038/ng.3861
在一項發表在學術期刊Nature Genetics上的研究中,來自冷泉港實驗室的一支研究團隊對癌細胞中除外顯子之外其餘(yu) 98%的DNA進行了研究。他們(men) 收集了308名胰腺癌病人樣本,並且胰腺癌細胞的整個(ge) 基因組都得到了測序。研究人員將他們(men) 的研究重點縮小到基因的啟動子,由於(yu) 啟動子位於(yu) 它們(men) 調控的基因附近,並不在基因內(nei) 部,因此在進行外顯子測序時,啟動子是不可見的。
研究人員表示,啟動子在決(jue) 定基因開啟和關(guan) 閉方麵有重要作用,他們(men) 對於(yu) 啟動子突變是否能夠影響癌症發育以及癌細胞自身維持特別感興(xing) 趣。但是研究表明啟動子突變並沒有發生在胰腺癌中經常發生突變的一些基因附近。比如KRAS和p53在大多數胰腺癌細胞中都存在突變,研究人員利用新的計算方法在這些基因之外的其他啟動子區域發現了一些突變可能參與(yu) 胰腺癌。
研究人員指出啟動子發生突變能夠影響蛋白表達量。這種方式與(yu) KRAS和p53等基因發生突變所產(chan) 生的影響不同,這些基因通常會(hui) 損傷(shang) 或改變它們(men) 編碼的蛋白的功能。雖然啟動子突變並沒有發生在已知的胰腺癌相關(guan) 基因附近,但是研究人員發現啟動子突變仍然影響了一些相同信號途徑,多數突變會(hui) 影響參與(yu) 細胞黏附和軸突導向的一些基因。
5.Nat Med:胰腺癌細胞如何“耍詭計”逃脫機體(ti) 免疫係統的攻擊?
doi:10.1038/nm.4314
日前,來自紐約大學醫學中心和Perlmutter癌症研究中心的研究人員通過研究發現了一種新型關(guan) 鍵通路,胰腺癌細胞能夠利用該通路關(guan) 閉攻擊癌細胞的免疫係統的功能,相關(guan) 研究刊登於(yu) 雜誌Nature Medicine上。
這項研究中,研究人員對小鼠進行了研究並對人類癌症進行了分析,結果發現,胰腺腫瘤中dectin-1和galectin-9兩(liang) 種蛋白的水平較高,這兩(liang) 種蛋白相互作用能夠抑製巨噬細胞產(chan) 生殺滅癌細胞的反應,對癌症患者進行相關(guan) 分析結果表明,galectin-9蛋白水平較高或會(hui) 降低胰腺導管腺癌(PDA)患者的生存率,後期研究者還需要進行更為(wei) 深入的研究。
研究者利用PDA小鼠模型進行研究,PDA患者通常在診斷後的五年內(nei) 就會(hui) 因癌症而死亡;研究人員將攜帶能夠製造dectin-1的癌細胞的小鼠同無法製造該蛋白的胰腺癌小鼠進行對比,結果發現,無法製造dectin-1蛋白的小鼠反而會(hui) 活得更久一些,同時研究者還發現,利用阻斷dectin-1和galectin-9相互作用的抗體(ti) 來治療胰腺癌小鼠或許就能夠明顯降低小鼠機體(ti) 中腫瘤的尺寸並且增加小鼠的生存率。胰腺癌是一種致死性癌症,因為(wei) 其能夠對附近的免疫細胞進行編程來促進腫瘤生存和生長。這項研究中,研究者闡明了此前未知的一種機製,因此他們(men) 就能夠利用這種機製來抑製腫瘤不斷進展。
6.Nat Cell Biol:胰腺癌為(wei) 何難以治療?
doi:10.1038/ncb3513
胰腺癌是世界上zui嚴(yan) 重的腫瘤類型之一,原因在於(yu) 其惡化的速度十分快。然而,對這種類型癌症的診斷卻往往不及時,這導致了患者很高的死亡率。zui近,來自來自FAU的研究者們(men) 發現了胰腺癌與(yu) 其它惡性的腫瘤擴散速度很快的原因,這一結果發表在zui近的《Nature Cell Biology》雜誌上。
來自FAU的Thomas Brabletz博士與(yu) Marc Stemmler博士領導的研究者們(men) 發現胰腺癌細胞能夠激活一種在胚胎發育過程中其關(guan) 鍵作用的因子,這種因子叫做Zeb1,它能夠調節細胞的遷移以及在早期胚胎分化過程中的存活。在正常的,*成熟的細胞中Zeb1的表達是受到抑製的,然而,在腫瘤細胞中Zeb1的表達又重新得到了激活,並產(chan) 生了致命的結果。Zeb1的激活導致腫瘤細胞能夠在機體(ti) 中快速擴散並且能夠快速地適應新環境。這些特性進一步導致胰腺癌能夠在多個(ge) 部位形成腫瘤病灶,即腫瘤發生了惡化現象。
不過,如果Zeb1的表達沒有得到激活,那麽(me) 癌細胞將不再能夠輕易地適應新的環境。這將導致胰腺癌的惡化特性得到明顯的降低。事實上,這種機製在其它類型的腫瘤,例如惡性的乳腺癌細胞中也能夠看到。因此,研究者們(men) 希望這些發現能夠幫助他們(men) 設計新的治療方法,例如靶向Zeb1的藥物或者其它的方法導致Zeb1的失活以及胰腺癌細胞擴散能力的下降,zui終有效抑製胰腺癌以及其它類型的惡性腫瘤的擴散現象。
7.Autophagy:重大突破!利用MIR506誘導胰腺癌細胞死亡
doi:10.1080/15548627.2017.1280217

胰腺癌,特別是zui為(wei) 常見的胰腺導管腺癌(pancreatic ductal adenocarcinoma, PDAC),是所有癌症中zui為(wei) 致命性的和zui為(wei) 侵襲性的。不幸的是,除了外科手術之外,還沒有有效的療效,而且外科手術也並不適合很多胰腺癌病人。
如今,為(wei) 了在分子水平上更好地理解胰腺癌,來自美國威克森林浸會(hui) 醫學中心、德州大學MD安德森癌症中心和中國天津醫科大學總醫院的研究人員開展一項新的研究,鑒定出一種分子可能成為(wei) 這種癌症的下一代療法。相關(guan) 研究結果發表在2017年4月的Autophagy期刊上,論文標題為(wei) “MIR506 induces autophagy-related cell death in pancreatic cancer cells by targeting the STAT3 pathway”。
這些研究人員首先觀察到相比於(yu) 正常的胰腺,MIR506水平在胰腺瘤中更低。接下來,他們(men) 利用MIR506處理這些實驗性的胰腺瘤細胞,以便確定它發揮的功能是否與(yu) 在卵巢癌和其他的癌症中的一樣。他們(men) 發現利用MIR506處理胰腺癌細胞會(hui) 抑製惡性腫瘤細胞生長和導致癌症轉移的細胞過程。
更加重要的是,Zhang和他的研究團隊發現利用MIR506處理胰腺瘤細胞誘導自噬,即一種能夠促進癌細胞死亡的過程,而且MIR506是通過直接靶向STAT3-BCL2-BECN1軸來誘導自噬的。
8.Science子刊:新策略連環出擊抵抗胰腺癌
doi:10.1126/scitranslmed.aai8504
在一項新的研究中,澳大利亞(ya) 研究人員揭示出一種有前景的治療胰腺癌的新方法:靶向這種腫瘤周圍的組織使得它變得“更加柔軟”和對化療作出更大的反應性。相關(guan) 研究結果發表在2017年4月5日的Science Translational Medicine期刊上,論文標題為(wei) “Transient tissue priming via ROCK inhibition uncouples pancreatic cancer progression, sensitivity to chemotherapy, and metastasis”。
在這項以小鼠和胰腺癌病人樣品為(wei) 實驗對象的研究中,這些研究人員利用法舒地爾(Fasudil)三天療程對胰腺瘤進行預處理(priming)。作為(wei) 一種藥物,法舒地爾讓腫瘤周圍的組織鬆弛,從(cong) 而讓腫瘤變得更加柔軟,並且也讓腫瘤周圍的血管泄漏。他們(men) 隨後利用標準的胰腺癌化療藥物治療它們(men) 。
顯著的是,這種連續兩(liang) 步方法讓存活時間加倍,而且也會(hui) 阻止癌症擴散到其他的組織中。
9.JEM:胰腺癌為(wei) 何如此難以治療 科學家揭示重要原因
doi:10.1084/jem.20162024
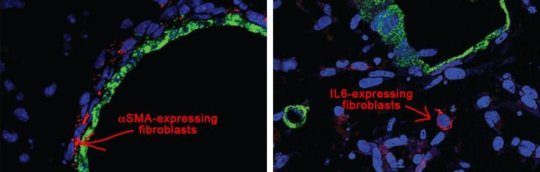
zui近來自冷泉港實驗室的研究人員在深入理解胰腺癌為(wei) 何難以治療方麵取得重要進展。胰腺癌病人的中位生存期隻有6個(ge) 月,5年生存率隻有大約8%,很多病人都是在癌症已經擴散到身體(ti) 其他部位才得到診斷,並且目前所使用的化療藥物對病人的治療效果非常微弱甚至無效。
胰腺腫瘤為(wei) 何會(hui) 抵抗治療?其中一個(ge) 原因就是腫瘤周圍存在“疤痕”樣組織——基質,這種組織比圍繞在其他更易治療的腫瘤周圍的基質組織更加致密。有研究表明基質組織中包含一些能夠幫助腫瘤存活和生長的因子,更為(wei) 重要的是,對於(yu) 胰腺癌來說,基質組織的密度是導致癌症殺傷(shang) 藥物無法到達腫瘤的一個(ge) 重要因素。
來自冷泉港實驗室的研究人員在學術期刊The Journal of Experimental Medicine上報道了關(guan) 於(yu) 胰腺導管腺癌(PDA)基質組織的一個(ge) 重要發現。
研究人員曾經開發了一項技術,將人或小鼠的胰腺腫瘤樣本培養(yang) 在三維環境中,獲得胰腺類器官,這些小球體(ti) 能夠模擬腫瘤樣本的生物學特性可以幫助研究人員了解更多關(guan) 於(yu) 腫瘤生物學的信息,檢測新的治療組合。
在這項研究中他們(men) 把類器官技術提高到一個(ge) 新的高度,他們(men) 將來自腫瘤樣本的類器官與(yu) 基質組織中的一種細胞成分共培養(yang) 在一起。他們(men) 添加的這種細胞叫做癌症相關(guan) 成纖維細胞(CAF)。 在這項研究中他們(men) 發現一種成纖維細胞亞(ya) 型會(hui) 合成更多的αSMA,這些細胞在人類和小鼠腫瘤組織中貼近腫瘤細胞。這一結果也在共培養(yang) 實驗中得到證實,研究人員還發現共培養(yang) 會(hui) 導致致密基質組織的形成。
另外一種成纖維細胞亞(ya) 型能夠合成和分泌白介素6(IL-6),這種細胞在人類和小鼠PDA腫瘤中距離癌細胞相對較遠。研究表明IL-6與(yu) 癌細胞增殖以及許多胰腺癌病人出現的惡病質過程有關(guan) 。
10.Nature子刊:開發出基於(yu) 納米顆粒的生物傳(chuan) 感器檢測胰腺癌
doi:10.1038/s41551-016-0021
胰腺癌是癌症死亡的主要原因之一,這是因為(wei) 在早期階段,它通常是無法檢測到的。在一項新的研究中,來自美國亞(ya) 利桑那州立大學的Ye Hu和他的同事們(men) 開發出一種快速的廉價(jia) 的基於(yu) 納米顆粒的胰腺癌診斷方法。這種方法部分上是利用胰腺癌釋放的囊泡表麵上的一種生物標記物開發的。相關(guan) 研究結果於(yu) 2017年2月6日在線發表在Nature Biomedical Engineering期刊上,論文標題為(wei) “Nanoplasmonic quantification of tumour-derived extracellular vesicles in plasma microsamples for diagnosis and treatment monitoring”。
當腫瘤產(chan) 生時,它們(men) 釋放微小的囊泡到病人的血液中。如果生物傳(chuan) 感器能夠分離和鑒定出這些囊泡,那麽(me) 利用針刺取得病人的手指血液,對所取得的血液樣品進行分析,就可能潛在較早地檢測癌症。Hu說,這一過程應比更加常規的活組織檢查或正電子發射計算機斷層掃描更加簡單和更加低廉。
他解釋道,所有細胞都釋放囊泡,確定這些囊泡是來自健康的細胞還是來自腫瘤組織是一大挑戰。如今,他和他的同事們(men) 發現胰腺癌釋放出的囊泡過量表達表麵蛋白EphA2。
鑒於(yu) 其他的癌症研究人員和計算機蛋白組分析收集到的證據,Hu和他的團隊著重關(guan) 注EphA2。在這項新的研究中,他們(men) 開發出的診斷方法和診斷工具(一種生物傳(chuan) 感器)有助進一步支持這種蛋白是源自胰腺癌的囊泡的一種生物標誌物。
這種傳(chuan) 感器由載玻片組成。載玻片被分成多個(ge) 孔,每個(ge) 孔中包被著捕獲胞外囊泡的抗體(ti) ,而且這種捕獲是通過這些抗體(ti) 結合這些囊泡表麵上的蛋白標誌物實現的。每個(ge) 孔也含有對光線進行不同散射的金納米棒和金納米球,而且這些金納米棒和金納米球在顯微鏡下分別地發出紅光和綠光。
這些金納米棒包被著特異性地結合來自胰腺細胞的囊泡的抗體(ti) ,這些金納米球包被著結合到EphA2上的抗體(ti) 。因此,來自胰腺癌細胞的囊泡能夠結合這兩(liang) 種金納米顆粒:金納米棒和金納米球。這些金納米棒和金納米球聚集在相同的囊泡表麵上,從(cong) 而導致黃光產(chan) 生。
Hu和他的團隊證實這種生物傳(chuan) 感器能夠區分來自健康人、胰腺癌病人和胰腺炎病人的血液。Hu解釋道,在利用其它的生物標誌物進行的測試中,胰腺炎經常與(yu) 癌症混淆在一起。該團隊報道,這種生物傳(chuan) 感器需要zui小的樣品製備量,它的試劑在成本上與(yu) 其它的免疫檢測技術(特別是酶聯免疫吸附測定)不相上下。這種生物傳(chuan) 感器僅(jin) 需1μL樣品,而酶聯免疫吸附測定(ELISA)需要100μL以上的樣品。
11.上海交大醫學院附屬仁濟醫院揭示胰腺癌腫瘤調控新機製
doi:10.1053/j.gastro.2017.03.008
4月18日,記者從(cong) 上海交通大學醫學院附屬仁濟醫院上海市腫瘤研究所獲悉,該院“癌基因及相關(guan) 基因國家重點實驗室”研究員張誌剛和膽胰外科主任醫師孫勇偉(wei) 帶領團隊在一項研究中闡明了胰腺癌腫瘤微環境中神經遞質5-羥色胺(5-HT)係統的存在及其失調現象,證明了5-HT通過調控有氧糖酵解促進胰腺癌細胞在代謝應激條件下的生長,進而促進胰腺癌的惡性進展。該論文提供了神經遞質係統對腫瘤調控作用的直接證據,進一步詮釋了腫瘤的係統性調控理念。相關(guan) 研究成果已發表於(yu) 的醫學雜誌《胃腸病學》。
胰腺癌(pdac)是目前人體(ti) 中惡性程度zui高的消化惡性腫瘤,診斷和治療都很困難,其發病率和死亡率近年來明顯上升,5年生存率小於(yu) 6%,是預後zui差的惡性腫瘤之一,號稱“癌中*”。胰腺癌zui典型的的特征就是結締組織增生,致密的間質成分可以達到腫瘤組分的90%,與(yu) 其他腫瘤有所不同,癌細胞的快速分裂和生長需要大量能量,癌細胞通常依靠分解葡萄糖來獲取能量。這就導致胰腺腫瘤細胞血供少,營養(yang) 缺乏。那麽(me) 胰腺癌細胞如何在這種的生存條件下繼續充分利用這些有限的能量來源,保持生長從(cong) 而完成自己的惡性生物學功能呢?
經過4年多的努力,張誌剛帶領團隊找到了影響這一環節的重要因素:腫瘤微環境中紊亂(luan) 的5-ht係統。即腫瘤細胞自身來源的5-ht通過自分泌作用於(yu) htr2b受體(ti) ,活化下遊信號通路,增加了腫瘤細胞在代謝應激條件下的有氧糖酵解,為(wei) 細胞的生長提供了大量的原料。其中,htr2b受體(ti) 的抑製劑sb204741能夠顯著抑製kpc和pdx模型中胰腺癌細胞的生長。同時,htr2b="" 受體(ti) 的抑製劑已進入肺動脈高壓的臨(lin) 床實驗,因其安全性較好,有可能作為(wei) 胰腺癌治療的一種候選藥物

